La calidad del agua para su uso en la agricultura es un aspecto crucial que repercute en el crecimiento y desarrollo de los vegetales. Actualmente toda agua utilizada en este sector, principalmente la destinada al riego y la fertirrigación, debe ser evaluada con la finalidad de prevenir posibles inconvenientes que se puedan presentar en el suelo o sustrato, y especialmente en el cultivo por el uso de agua de mala calidad. Los problemas directos relacionados con la calidad del agua son: salinidad, sodicidad, alcalinidad y toxicidad por iones específicos. Estas limitantes se pueden medir mediante los siguientes parámetros: conductividad eléctrica (C.E.), relación de adsorción de sodio (RAS), pH y concentración de elementos potencialmente tóxicos (Na+, Cl-, B).
De los problemas relacionados con la calidad del agua, la alcalinidad es una de las más frecuentes. La alcalinidad se define como la capacidad del agua para neutralizar ácidos, debido a la presencia de bases como bicarbonatos (HCO3-) y carbonatos (CO32-), principalmente. Estos aniones en solución están comúnmente asociados o apareados con cationes de calcio (Ca2+), magnesio (Mg2+), potasio (K+), sodio (Na+) y otros.
Los carbonatos y bicarbonatos son sales presentes en el agua que a mayor concentración aumentan el pH. Sin embargo, cabe destacar que la alcalinidad y el pH del agua son dos factores relacionados, pero no son lo mismo. La confusión entre un pH alto y una alta alcalinidad se debe a que el agua es llamada alcalina si tiene un pH mayor a 7, y se dice que tiene alta alcalinidad si tiene una alta concentración de bases (Torres et al., s.f.).
Riesgos de la alcalinidad del agua
Cuando se utilizan aguas con alta alcalinidad en sistemas de riego sin tratamiento previo, se corre el riesgo de taponamiento de goteros (Figura 1), debido a que los carbonatos y bicarbonatos precipitan con los cationes presentes en el agua o la solución nutritiva, formando compuestos de baja solubilidad como: carbonatos de calcio, bicarbonatos de calcio, sodio y magnesio, principalmente. Además, un pH alto del agua afecta la disponibilidad de micronutrientes como hierro, zinc y manganeso. También puede existir un desequilibrio en la relación Ca/Mg que da lugar a desordenes fisiológicos en los cultivos.
¿Cómo disminuir la alcalinidad del agua?
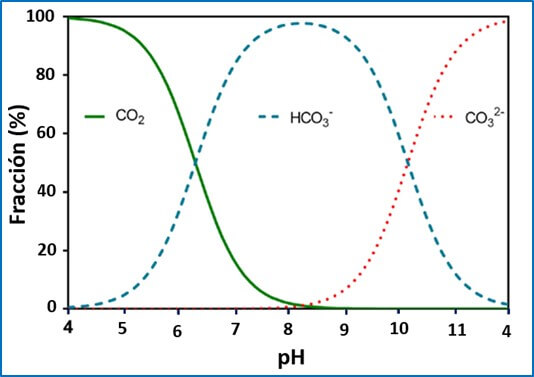
La alcalinidad del agua es relativamente fácil de corregir, sólo se requiere acidificar el agua y de esta forma se reduce la concentración de las bases, esencialmente bicarbonatos debido a que es la especie principal de carbono inorgánico (ácido-base) presente en las aguas naturales con pH de 6 a 9 (Figura 2). En estas aguas solo es posible encontrar presencia de carbonatos en pH mayor a 8.0.

|
Figura 1. Taponamiento de emisores de cintas de riego por precipitación de carbonatos. Fuente: Intagri. |
|
Figura 2. Relación entre el pH y la proporción relativa de especies de carbono inorgánico: CO2 (+H2CO3), HCO3- y CO2- en las aguas naturales. Fuente: Schwarzenbach y Meier, 1958. |

|
Figura 3. La adición de ácidos en el agua tiene como objetivo corregir pH neutralizando la alcalinidad y aportar nutrientes. Fuente: Intagri. |
La acidificación del agua tiene como objetivo neutralizar la acción alcalina hasta dejar como mínimo 0.5 miliequivalentes por litro (meq/L) de bicarbonatos. A esta concentración ya no se producen daños al cultivo y se baja el pH de la solución alrededor de 5.5 a 6.5, cuyo rango es donde existe mayor disponibilidad de todos los nutrientes. Los ácidos más comunes para mejorar la calidad del agua son el nítrico (HNO3), el fosfórico (H3PO4) y el sulfúrico (H2SO4). Este último es el más utilizado por ser más económico, sin embargo el ácido nítrico y fosfórico a menudo se usan en la horticultura protegida debido a que cumplen dos funciones: acidificar y aportar nutrientes. Para elegir el ácido a utilizar de debe considerar las siguientes características: de fácil uso, seguridad, costo y aportes nutricionales.
Los ácidos más comunes para mejorar la calidad del agua
Ácido Nítrico. Este ácido se usa como materia prima para la producción de fertilizantes nitrogenados, sin embargo también se usa para disminuir el pH del agua, ya que al agregarlo a este medio se disocia en forma de nitratos (NO3-) e hidrógenos (H+). Esta reacción cumple dos funciones: por la acción del H+ como acidificante, mientras que los NO3- liberados son absorbidos por los cultivos. Su uso es común en la aplicación de nutrientes a través del sistema de riego, principalmente en la producción de hortalizas intensivas. En el mercado de agroquímicos es posible encontrar distintas purezas y concentraciones de este ácido (Cuadro 1). Para uso agrícola se emplea el ácido grado industrial, mientras que en laboratorio se usa grado reactivo. Al usar este ácido para neutralizar la calidad del agua, se debe tomar en cuenta que también aporta nitrógeno y este aporte se debe considerar al momento de calcular el programa de nutrición.
Ácido Fosfórico. Se emplea en cultivos en suelo o sustrato como fuente de fósforo, además acidifica el agua. Al ser una fuente de fósforo, el aporte de este nutriente por el ácido se debe considerar en el cálculo del programa de nutrición. En la soluciones nutritivas para cultivos protegidos, existe la restricción que su uso no puede ser mayor a 1.5 meq/L, que es la demanda máxima de la mayoría de los cultivos.
Ácido Sulfúrico. Es un compuesto altamente corrosivo, producido en gran escala a nivel mundial por sus múltiples usos, entre ellos la producción de fertilizantes. Al igual que los otros dos ácidos anteriormente mencionados, es considerado un ácido fuerte que se disocia fácilmente en iones de hidrógeno (H+) e iones sulfato (SO42-), donde los H+ le confieren el poder neutralizante. Es de los ácidos más utilizados para disminuir la alcalinidad del agua para uso agrícola, además es el ácido cuyo precio es el más económico.
|
Cuadro 1. Densidades y purezas de los ácidos comerciales. Fuente: Castellanos, 2000. |
|||
|
Densidad |
Riqueza del ácido % en peso |
||
|
Kg/L |
Nítrico (HNO3) |
Fosfórico (H3PO4) |
Sulfúrico (H2SO4) |
|
1.34 |
55 |
||
|
1.40 |
65 - 70 |
50 |
|
|
1.50 |
95 |
53 |
60 |
|
1.60 |
75 |
||
|
1.73 |
85 |
77 |
|
|
1.84 |
90 - 98 |
||
Antes de adicionar cualquier ácido en el agua para uso agrícola, se debe efectuar un análisis químico para conocer la calidad del agua y en este caso determinar su alcalinidad. Con este tipo de análisis es posible conocer los niveles de bicarbonatos y carbonatos, y en caso de que la suma de estos dos sea mayor a 0.5 meq/L de agua, es necesario seleccionar y calcular la cantidad de ácido necesario para ajustar la alcalinidad del agua. A continuación un ejemplo del procedimiento para calcular la cantidad de ácido requerido para llevar la alcalinidad del agua a un nivel óptimo considerando que cada ácido tiene diferente densidad, pureza y capacidad neutralizante.
Cálculo de ácido necesario para mejorar la calidad del agua
Ejemplo: Después de mandar a analizar un agua de pozo profundo, el laboratorio reporta que tiene 4 meq/L de alcalinidad. ¿Cuánto ácido sulfúrico tengo que agregar para neutralizar la alcalinidad del agua y esta se pueda utilizar en cultivos en sustrato?
Los datos que se requieren para hacer el cálculo de ácido a agregar son la densidad y la pureza del ácido. Estos datos los debe proporcionar el proveedor de la sustancia. Para este caso se utilizará un ácido cuya densidad es de 1.84 kg/L o gr/cm3, con una pureza al 96 %.
1. Calcular la cantidad de ácido para neutralizar 1 meq/L de alcalinidad. Se aplica la siguiente formula:
|
Ácido = (1 meq) x (Peso equivalente) x (1/densidad) x (100/pureza) |
Donde:
Peso equivalente del ácido: en este caso el ácido sulfúrico, el cual tiene un valor de 49.
Densidad: la densidad marcada del ácido, esta puede variar según el fabricante. Para este caso se usa un ácido con densidad de 1.84 kg/L.
Pureza: también varía dependiendo el proveedor, pero en este caso su valor es de 96.
2. Sustituir valores en la fórmula:
|
Ác. Sulfúrico (H2SO4) = (1 meq) x (49 Peq) x (1/1.84 g/ml) x (100/96)= 27.74 ó 28 redondeado. Este valor son los mililitros de ácido sulfúrico necesarios para neutralizar un miliequivalente de alcalinidad en un m3 (1000 litros) de agua. |
3. Calcular la cantidad de ácido para neutralizar la alcalinidad del agua. Después de tener la cantidad de ácido para neutralizar 1 meq de alcalinidad, se procede a calcular la cantidad de ácido a aplicar en el agua para dejar solo 0.5 meq de alcalinidad, es decir, se desea neutralizar 3.5 meq de alcalinidad. Entonces, solo multiplica la cantidad de ácido necesario para neutralizar 1 meq de alcalinidad por la cantidad total de alcalinidad que se desea neutralizar.
|
(28 ml) x (3.5 meq) = 98 mililitros de ácido sulfúrico por m3 de agua para neutralizar la alcalinidad del agua. |
Este procedimiento estima la cantidad de ácido que se necesita para llevar la alcalinidad del agua a una concentración óptima que favorezca la disponibilidad de nutrientes y minimice los daños al sistema de riego, principalmente problemas de taponamiento de goteros. Cabe destacar que es necesario contar con equipos portátiles que midan el pH del agua in situ con la finalidad de hacer ajustes para tener mejor control sobre la calidad del agua.
Cita correcta de este artículo
INTAGRI. 2017. El Uso de Ácidos para Mejorar la Calidad de Agua. Serie Agua y Riego Núm. 18. Artículos Técnicos de INTAGRI. México. 5 p.
Fuentes consultadas
- Arévalo, Z.J.2015. Curso Soluciones Nutritivas para Hortalizas Bajo Cubierta. Intagri. México.
- Castellanos, Z.J. 2014. Sesión del Diplomado Internacional en Fertirriego. Intagri, México.
- Pellicer, B.C.; Rincón, S.L. 2005. Productos Específicos para Fertirrigación y Acidificación de Disoluciones de Riego. Vida Rural (216):28-34.





A quién corresponda:
Siempre he tenido una duda. Una pregunta, ¿éste mismo procedimiento se aplica para calcular la cantidad de ácido por m3 de agua para los ácidos nítrico y fosfórico?, ¿esto a pesar de que el ácido sulfúrico es diprótido?.
Saludos cordiales.
Manuel Galindo
Hola.El procedimiento es el mismo para el cálculo de los ácidos en general, debido a que las unidades utilizadas en esta operación son miliequivalentes sobre litros (meq/L).
ME ANCATARIA QUE ME PROPORCIONEN TEMAS DE RIEGOS Y DRENAJE CON SUS RESPETIVOS CALCULOS
Te invitamos a visitar la sección de riego en nuestra página.
Saludos.
Muchas gracias por el comentario. Puedes ponerte en contacto al correo de intagri@intagri.com.mx
Saludos.
Hola !! Queria consultar x el probl q tenemos con el agua, tenemos un canal de drenaje q nos cruza x un campo de golf q estamos haciendo, resulta q mandamos analizar el agua y nos da 9 ph y con poca salinidad pero ese canal es de drenaje x la epoca q se usa de los agricultores, es la napa q va a parar todo el sobrante de esas tierras regadas q dicho sea de paso la usan para pastura de alfalfa y agricultura, queremos usar esa agua y nos dicen q para el cesped es muy malo para el cesped esa medida de ph, primera preg es saber como se baja y medidas para bajar el ph en una laguna q armamos de 2 millones de litros de agua q vamos almacenar, y la otra preg si se mezcla con otra agua q tiene menos ph q riesgo corre mezclar el agua, digamos meterle agua de 9 ph q tiene ese canal al agua q vamos a tener x un tiempo con menos ph ? Se entiende ?gracias
Hola. Respondiendo a tus preguntas:
1. la forma de bajar el pH es la inyección de ácidos como lo indica este artículo. Es importante que por el volumen que mencionas, mejor inyectes el ácido en tu sistema de riego y no en el estanque. Primero debes calcular la cantidad de ácido necesario para llegar al pH deseado, es decir cuantos mL de ácido/L de agua necesitas.
2. Al mezclar dos aguas con distinto pH, el pH en general se estabilizara en algún punto medio. Es importante que se vuelva a determinar cuando se mezclen los dos tipos de aguas.
Saludos.
quisiera que me brinden informacion de utilizacion del acido sulfurico para acidificar el agua de riego y como calcular la curva de neutralizacion.... gracias
Hola.
En el articulo se explica un ejemplo de como utilizar el ácido sulfúrico para acidificar el agua, lo cual es la base para ir realizando la curva de titulación.
Saludos.
En el ejemplo que muestran indican que la alcalinidad del agua es de 4 meq/L, pero luego de calcular la cantidad par neutralizar 1 meq/L calculan para 3.5. ¿Cuál es la razón?
Se calcula para 3.5 meq/L porque el propósito es dejar el agua con 0.5 meq/L de bicarbonatos. Esto se hace así para evitar que se acidifique excesivamente el agua, pues en este caso los 0.5 meq/L de bicarbonatos actúan como un colchón que evita eso, ya que también a pH ácidos se tiene baja absorción en algunos nutrimentos. Como se menciona en la nota, con 0.5 meq/L de bicarbonatos se asegura tener un pH entre 5.5 a 6.5, donde la mayoría de los nutrimentos están disponibles para su absorción.
Saludos.
Lo invitamos a leer la información publicada en www.intagri.com para mayor información, saludos y gracias por comentar.
Muy interesante el artículo de alcalinidad, didáctico y práctico. Gracias
Miguel Ramirez
Saludos, que bueno que le haya sido útil, gracias por comentar.
Saludos Intagri, Gracia por la información del articulo El Uso de Ácidos para Mejorar la Calidad del Agua de Riego. Pero tengo una interrogante la cual la planteo así: El proveedor Arysta LifeSciense en su producto PHASE 1 que es un coadyuvante y corrector de pH proporciona la siguiente información
COMPOSICIÓN QUÍMICA: P/V
Agentes acidificantes (ácido fosfórico, cítrico y pentandioico): 40.80 %
Alcohol tridecil polioxietilenado: 20.00 %
Dietilenglicol: 6.00 %
Ingredientes inertes: 33.20 %
Total: 100.00 %
Contiene 408.00 gr de i.a. por litro de producto comercial.
Densidad 1.258c gr/cc
La interrogante en concreto es; ¿Cómo obtengo la pureza con la información que proporciona el proveedor?
De antemano muchas gracias por la ayuda.
Le sugerimos contactar directamente a algún técnico de UPL, saludos y gracias por comentar!
Saludos
Cómo puedo bajar la conductividad electrica de una agua con C.E. 6 dS/m de un pozo subterraneo
Gracias por la respuesta
Walter Condezo
Saludos, buen día, para hacer eso solamente usando un tratamiento de osmosis inversa, gracias por su comentario.
Buenos dias, tengo una duda con respecto al ejemplo. A que se debe que utilizan un peso equivalente del H2SO4 de 49? el peso equivalente del H2SO4 no seria 98? 1x2+32x1+16x4=98.
Desde ya muchas gracias